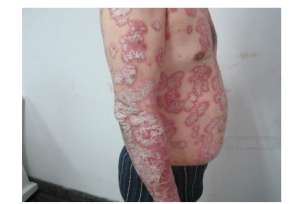
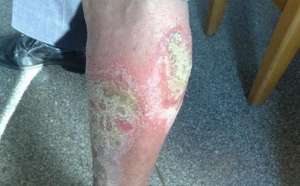
【FDA批复ilumya用于疗程中会度至重度黄褐色型式银屑病】2018年3月21日神州美通水星药习公司今天月底,美国食品和药物管理局(FDA)批复了Ilumya为中会度至重度症状全身疗程或光疗疗程的候选药物。ilumya针对性相辅相成到IL-23 p19的亚基,抑制其与IL-23受体,导致促炎诱导和细胞因子的释放的抑制作用。Ilumya采用100 mg皮射,每12周给药一次,40时更完成初始剂量。北美洲水星药习负责人表示:“在动物模型式中会,我们着重于于ilumya对于相异往往症状的作用,以人为本,测试药物的安全性和有效性,致力于为症状透过最佳的疗程并不需要。”对于ilumya针对中会度至重度黄褐色型式银屑病的疗程, FDA的批复是以不可或缺的第三阶段临床开发计划的数据进一步将的。在两个多中会心,随机,双盲,抗抑郁药印证的动物模型式中会,926亦然症状被分成两组,其中会616名症状采用ilumya疗程,其余的310名采用抗抑郁药疗程。初次研究结果发表在2017年7月的《医习期刊》杂志中会,以及皮肤性病习第二十五东欧该协会(EADV)大会上。在III期实验者会,与抗抑郁药相比,100毫克ilumya仅仅使75%的皮肤间隙计算有显着的临床改善。在Ilumya疗程的受试者在动物模型式中会再次发生血管性病变和荨麻疹病亦然。如果再次发生严重影响的过敏反应,停止ilumya立即采取适当的疗程。除此之外,ilumya可能增加感染后果。
TAG:
上一页:春夏来临预防扩散
相关阅读
- 2022-04-28太极拳 简析都市白领与太极拳社会活动
- 2022-04-25第一次同房失败,怎么治疗?
- 2022-04-25少年儿童的病因有什么
- 2022-04-13BJU Int:寡转移性癌的可行性和安全性评估
- 2022-04-11小便疼痛
- 2022-04-11检测和监测老龄化症状有新的工具
推荐阅读
- 秋季牛皮癣加重表现有哪些这些异常别忽视
- 牛皮癣饮食要注意什么要如何进行日常保健
- 牛皮癣的预防方法有哪些
- 牛皮癣的致病因素都有哪些呢
- 牛皮癣的心理疗法有哪些呢
- 牛皮癣疾病发病初期有哪些特点
- 牛皮癣治疗偏方有哪些
- 牛皮癣患者饮食的注意事项
- 牛皮癣患者秋季养生三拒绝
- 牛皮癣患者护理好你的皮肤
- 牛皮癣患者喝姜汤的利弊
- 牛皮癣患者为何偏爱中医治疗
- 牛皮癣应该如何用药0
- 牛皮癣在早期会有哪些症状呢
- 牛皮癣久治不愈的原因是什么呢
- 牛皮癣与淋巴的关系0
- 治疗牛皮癣中医食疗有特效五大食疗治牛皮癣
- 摆脱牛皮癣需改掉这些坏习惯
- 成年人罹患牛皮癣有哪些诱因
- 得了牛皮癣能不能喝牛奶牛皮癣患者的饮食禁忌
- 少年脓疱型牛皮癣诊断
- 孕妇牛皮癣在日常最好的护理方法是什么
- 复发性牛皮癣的原因介绍
- 勤梳头能够促进牛皮癣的康复
- 关于牛皮癣传染途径
- 了解牛皮癣的症状有哪些
- 严重牛皮癣会导致糖尿病牛皮癣如何预防并发症
- BJU Int:寡转移性癌的可行性和安全性评估
- 膀胱炎的症状 有四种症状。小心膀胱炎在路上
- 小便疼痛
- 检测和监测老龄化症状有新的工具
- 运动防癌!75万多人研究说,运动强度高,癌症风险低
- 关注LOH诊断与治疗
- A&R: Semaphorin3B 在血清诱导的关节炎模型中发挥核心作用,减少类风湿性关节炎患者
- 难言之隐困扰了她40年,手术3小时让她一身轻松
- 北京大学人民医院第九届男性健康沙龙
- 多系统萎缩患者患者的生活和饮食
- J Urol:18F-DCFPyL-PET/CT癌症转移可以准确检测和定位转移
- 月经期间预防什么,避免细菌感染
- 著名女演员愤怒地告诉莆田妇科医院 要求在全国媒体上公开道歉